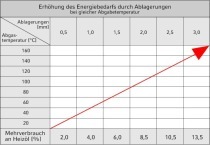
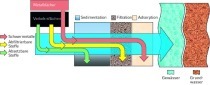
Wasseraufbereitungsverfahren
Die optimale Nutzung natürlicher WasservorkommenDie moderne Wasseraufbereitung verringert den Wasserverbrauch. Sie verbessert die Wasserqualität und erhöht dadurch die Wirtschaftlichkeit der jeweiligen Produktion und die Lebensdauer der Apparate und Anlagen.
Naturstoff Wasser
Die Naturstoffe Wasser und Luft ermöglichen das Leben auf der Erde. Der größte Teil des Wassers befindet sich in der Hydrosphäre (Wasserhülle), welche die Lithosphäre (Erdkruste) bedeckt, während die Atmosphäre (Lufthülle) nur noch wenig Wasser enthält. Der Wasservorrat der Erde wird auf ca. 1423 x 1012 m3 geschätzt; von denen ca. 98 % der Hydrosphäre zugeordnet werden.
Hydrosphäre = 1397 x 1012 m3
Lithosphäre = 25 x 1012 m3
Atmosphäre < 1 x 1012 m3
Erde, total ð 1423 x 1012 m3
Der ständige Wasserkreislauf auf der Erde wird durch die Sonnenstrahlung als Energiequelle ausgelöst...
Naturstoff Wasser
Die Naturstoffe Wasser und Luft ermöglichen das Leben auf der Erde. Der größte Teil des Wassers befindet sich in der Hydrosphäre (Wasserhülle), welche die Lithosphäre (Erdkruste) bedeckt, während die Atmosphäre (Lufthülle) nur noch wenig Wasser enthält. Der Wasservorrat der Erde wird auf ca. 1423 x 1012 m3 geschätzt; von denen ca. 98 % der Hydrosphäre zugeordnet werden.
Hydrosphäre = 1397 x 1012 m3
Lithosphäre = 25 x 1012 m3
Atmosphäre < 1 x 1012 m3
Erde, total ð 1423 x 1012 m3
Der ständige Wasserkreislauf auf der Erde wird durch die Sonnenstrahlung als Energiequelle ausgelöst und aufrechterhalten. So erhält die Erde Wasser aus der Atmosphäre in Form von Niederschlägen. Dabei verdunstet ein Teil des Wassers sofort und kehrt in die Atmosphäre zurück.
Wasser tritt in den Aggregatzuständen
fest, als Eis (tW < 0 °C),
flüssig, als Wasser (0 °C < tW < 100 °C),
gasförmig, als Wasserdampf (tW > 100 °C)
unter Normalbedingungen auf. Das Zweikomponentensystem Wasser (H2O) besteht aus den chemischen Elementen Wasserstoff (H) und Sauerstoff (O), wobei die Wasserstoffatome kovalent an das Sauerstoffatom gebunden sind. Zwischen den Wassermolekülen herrscht eine Wasserstoffbindung, die so genannte Wasserstoffbrücke (Bild 1).
Wasservorkommen
Die Wasservorräte der Erde
Ozeane = 1378 x 1012 m3
Gletscher = 16,7 x 1012 m3
Flüsse und Seen = 0,025 x 1012 m3
Grundwasser = 0,275 x 1012 m3
Wasservorkommen ð 1395 x 1012 m3
unterscheiden sich erheblich in der Wasserqualität. Die folgenden Wasservorkommen beschreiben die Ursachen.
Ozeane
Die Weltmeere haben eine Oberfläche von ca. 361 x 109 km2 bei einer mittleren Wassertiefe von ca. 3800 m und bedecken somit ca. 71 % der Erdoberfläche. Die Stoffdichte des Meerwassers ist abhängig vom Druck der Wassermasse, dem Salzgehalt und Wassertemperatur. Der durchschnittliche Salzgehalt beträgt 35 ‰, in Gebieten mit hoher Verdunstung bis 41 ‰. Die Wassertemperaturen an der Oberfläche liegen zwischen - 2 und + 30 °C; sie nehmen mit der Wassertiefe ab. Die Wassererwärmung erfolgt durch Sonneneinstrahlung, Wärmeaustausch mit den Luftströmungen, sowie Umwandlung mechanischer Energie der Meeresströmungen infolge der inneren Reibung des Wassers.
Der Wärmeabfluss von der Meeresoberfläche erfordert eine entsprechende Abstrahlung, Wärmeleitung und Verdunstung, für die dem Meer die notwendige Energie entzogen wird. Infolge der großen Wärmespeicherung durch die Ozeane verzögern sich die Auswirkungen von Klimaveränderungen um mehrere Jahre.
Die Anziehungskräfte von Mond und Sonne auf die Wassermassen der Ozeane lösen die Gezeiten – Ebbe und Flut – aus. Es sind die wichtigsten Strömungen in den Meeren. Gezeiten- und Flutwellen (Tsunamies), meist als Folge von Erdbeben, sind schnelle Wellen entlang der Küsten, die Überschwemmungen und verheerende Verwüstungen verursachen können.
Gletscher
Gletscher entstehen in Gebieten mit häufigem Schneefall. So erhöht sich die Schneeschicht von Jahr zu Jahr und wird ständig tiefer gedrückt. Unter dem Druck nachfolgender Schichten erfolgt die Umwandlung in Eis. Hoher Druck auf die unteren Schichten macht das Eis plastisch, so dass es zu fließen beginnt.
Gletscher befinden sich in allen Klimazonen, z. B.
in den Tropen oberhalb 5000 m Höhe;
als Inlandeis der Antarktis mit einer Mächtigkeit > 4000 m bzw. in Grönland mit einer Höhe von ca. 1500 m.
Gegenwärtig sind fast alle Gletscherhöhen rückläufig. Das Abschmelzen erhöht den Meeresspiegel um 3 mm/a. Beim Schmelzen aller Gletscher würde er um etwa 50 m ansteigen.
Flüsse und Seen
Das geringste Wasservorkommen bilden die Flüsse und Seen. Die Flüsse transportieren Regenwasser von den Gebirgen hinab bis zu den Meeren, ergänzt durch das Schmelzwasser der Gletscher und des saisonalen Schneefalls. In Trockenperioden werden die Flüsse auch durch Speicherwasser der Seen und Grundwasser gespeist.
Strömungsgeschwindigkeit und Wasserstand der Flüsse sind vom jeweiligen landschaftlichen Gefälle abhängig. Vereinfacht gilt:
w0 = Þg x h in [m/s] (Gleichung 1)
mit: g = Erdbeschleunigung [= 9,80665 m/s2 (Normwert)]
h = mittleres Gefälle (m)
Folgende Strömungsformen werden angenommen:
w < w0 laminare Strömung,
w > w0 turbulente Strömung,
Die Grenzgeschwindigkeit wird mit w0 = 3 m/s vorgegeben. Bei einer laminaren Strömung kann Gegenwind Druckwellen gegen die Strömungsrichtung aufbauen, während turbulente Strömungen keine Druckwellen zulassen. Kritische Zustände infolge ungünstiger Strömungsverhältnisse Wasserstand / Durchfluss erfordern bauliche Maßnahmen, z. B. Kanalsysteme.
Die Seen entstehen durch Geländevertiefungen, undurchlässige Bodenschichten oder extreme Niederschläge. In Trockengebieten sind Seen selten, obwohl sich die größten Seen der Erde, z. B. Kaspisches Meer, Aralsee usw., in ausgewiesenen Trockenzonen befinden.
Aufgrund starker Verdunstung haben viele Seen keinen Abfluss und sind deshalb besonders salzhaltig. Bedeutende Seen liegen unterhalb des Meeresspiegels, z. B. das Tote Meer.
Der Wasserkreislauf in den Seen ist von der jeweiligen Temperaturverteilung und den saisonalen Veränderungen abhängig. Bei gleichen Temperaturen an der Oberfläche und in der Tiefe entsteht eine gute Wasserzirkulation, da der gesamte Wasserinhalt der Windeinwirkung unterliegt.
Beeinflusst der Wind nur die Wasseroberfläche, bilden sich Temperaturschichten. Die Sprungschicht zeigt plötzliche Temperaturänderungen, dagegen sind Temperaturschwankungen in der Tiefenschicht vernachlässigbar. Eine Wasserumwälzung ist aber für die Sauerstoffzufuhr in der Tiefe und für die dortigen Lebensbedingungen besonders wichtig.
Seen wirken als Wärmespeicher. Ihre jährliche Wärmeabsorption beträgt 120 kJ/cm2. Sie dienen auch als Wasserspeicher zum Ausgleich der Wasserversorgung der Flüsse. Außer Windeinfluss und Befälle zwischen Zu- und Abluft beeinflussen auch Seiches (in etwa: stehendde Wellen) die Strömung in den Seen. Hierbei handelt es sich um periodische Schwankungen des Seespiegels infolge von Windstau. Der Wind versucht die Wasseroberfläche in seine Richtung zu beeinflussen. Diese will den Gleichgewichtszustand beibehalten. Hierdurch entstehen Schwingungen in Richtung Zentrum der Wassermasse, die eine beachtliche Wassermenge in die unteren Wasserschichten verlagert.
Grundwasser
Grundwasser gibt es auf der gesamten Erde, auch in der Wüste, z. B. Sahara, da es dort nicht verdunsten kann. Es handelt sich um Sickerwasser, welches als Regenwasser in den Boden eindrang oder fossiles Wasser vulkanischen Ursprungs, eingeschlossen in Sedimentschichten. In den oberen Bodenschichten befindet sich noch Luft, während in den unteren Schichten das Wasser jeden Spalt ausfüllt. Grundwasser kann unter hohem Druck an die Erdoberfläche gelangen. So entstehen heiße Quellen (Thermalbäder). In Island liefern Geysire vielfach Wärmeenergie.
Die chemische Beschaffenheit des Bodens und der Gesteine im Bereich der Versickerung bestimmen den Salzgehalt des Grundwassers. Es enthält allgemein mehr Minerale als Oberflächenwasser, sowie Eisen und Mangan.
Nutzungsformen des Wassers
Einteilungskriterien
Der Wasserzustand
Rohwasser,
Reinwasser,
Abwasser
bestimmt die möglichen Nutzungsformen des Wassers. Diese unterscheiden sich durch Wasserbedarf und -verbrauch.
Wasserbedarf = 100 %
– Wiederverwendung = 25 %
– Abwasser = 73 %
= Wasserverbrauch = 2 % (Schätzwert)
Beispielsweise wird der Trinkwasserverbrauch je Einwohner in Deutschland mit ca. 130 l/d angenommen. Die Kühlung von 1 kg Rindfleisch erfordert durchschnittlich 10 l Wasser, welches aber bei entsprechender Installation wieder verwendet werden kann. Der Wasserbedarf der Industrie beträgt nur die Hälfte des Wasserbedarfs für die Energieerzeugung, jedoch ist ihr Wasserverbrauch etwa 10fach größer als der in den Kraftwerken.
Der Rohwasserzustand ist hauptsächlich abhängig von den Wasservorkommen.
Die direkte Nutzung des Rohwassers ist beschränkt auf die Anwendung als
Prozess- und Kühlwasser, insbesondere in der Energieerzeugung;
als Transportwege der Personen- und Güterschifffahrt.
Die Kühlwassertechnik beruhte früher auf einer Durchlaufkühlung, wobei das Rohwasser dem Einlaufbauwerk des Vorfluters entnommen, über Wärmeaustauscher (Kondensatoren, Kühler u.a.) geführt und erwärmt in den Vorfluter, evtl. über ein Auslaufbauwerk, zurückgeleitet wurde.
Die Wiedereinleitung des Kühlwassers in die Gewässer ist infolge der Erwärmung problematisch, da die maximale Aufwärmspanne überschritten werde kann. Der Rückfluss in die Brunnen ist aus hygienischen Gründen unzulässig. Moderne Kühlwassersysteme arbeiten mit Verfahren der Wasserrückkühlung nach einer entsprechenden Aufbereitung des Rohwassers.
Die Nutzung des Reinwassers bestimmt die erforderliche Wasseraufbereitung. Öffentliche Wasserwerke sichern die Trinkwasserversorgung der Bevölkerung. Die Trinkwasserverordnung (DIN 2000) beschreibt die Eigenschaften des Trinkwassers:
farblos, klar, kühl, geruchlos, geschmacklich neutral;
geringer Gehalt gelöster Stoffe;
frei von Krankheitserregern, d.h. frei von Mikroorganismen und Viren.
Diese Wasserqualität ist auch für die Lebensmittelproduktion erforderlich. Die industrielle Rohwasseraufbereitung bekämpft hauptsächlich die Wasserverschmutzung zum Schutz der Wassersysteme und ihrer Werkstoffe gegen Korrosion und Verstopfung.
In der chemischen Industrie ist Reinwasser ein universelles Lösungsmittel.
Nach dem Wasserhaushaltsgesetz (WHG) bzw. der Abwasserverordnung ist häuslich, gewerblich, landwirtschaftlich oder anderweitig genutztes Wasser, sowie Niederschlagswasser, das aus dem Bereich bebauter oder befestigter Flächen abfließt, Abwasser im Sinne des Gesetzes. Diese Vorschriften nennen Parameter zur Beurteilung der Schädlichkeit des Abwassers, z. B.:
absetzbare Stoffe und deren organischer Anteil;
oxidierbare Stoffe als chemischer Sauerstoffbedarf (CSB),
Quecksilber, Cadmium und ihre Verbindungen;
Giftigkeit gegenüber Tieren (Fischen) und Pflanzen.
Abwasser ist vor der Entsorgung in öffentlichen Gewässern den öffentlichen oder industriellen Kläranlagen zuzuführen.
Physikalisch-chemische Wasseranalyse
Grundlage einer Beurteilung der Wasserqualität ist die physikalisch-chemische Wasseranalyse. Jede Durchführung beruht auf der Auswahl von Parametern, die vom Wasserzustand und seiner Nutzung abgeleitet werden. Allgemein werden folgende physikalischen Werte ermittelt:
pH-Wert,
elektrische Leitfähigkeit,
Wasserhärte,
Säurekapazität.
Der pH-Wert nennt die Wasserstoffionen-Konzentration und somit die Azidität des Wassers. Der Messbereich umfasst pH = 0 bis 14, unterteilt in die Teilbereiche
pH < 7 ➝ sauer,
pH = 7 ➝ neutral,
pH > 7 ➝ basisch bzw. alkalisch.
Mittels Platinelektronen erfolgt die Messung der elektrischen Leitfähigkeit. Aus der Gleichgewichtsbedingung
∑ Kationen = ∑ Anionen (1 µS/cm = 1 mg CaCO3)
und der Annahme des Richtwertes
Leitfähigkeit / Salzgehalt ð 2 µS/cm= 1 mg/l H2O
leitet sich die Wasserhärte ab.
Gesamthärte: GH = [( + /100 [mmol/l]
bzw.: GH = [( + /17,86 [°dH]
Karbonathärte: KH = ( ) /100 [mmol/l]
bzw.: KH = ( ) /17,86 [°dH]
Die Säurekapazität erklärt die Verhaltensweisen des Wassers bei unterschiedlichen pH-Werten. Sie wird durch Titration mit einer 0,1n-Mineralsäure ermittelt. Wichtig ist der Vergleich des aktuellen pH-Wertes mit dem Sättigungs-pH-Wert. Er ist abhängig von der Calciumhärte KH, der Alkalität, der Feststoffkonzentration und der Wassertemperatur. Aufgrund von Erfahrungswerten gilt:
pH > pHS =Bildung von Ablagerungen
auf den Werkstoffoberflächen infolge Härteausfalls,
pH < pHS = korrosives Wasserverhalten.
Als Bewertungskriterien kommen folgende Indices zur Anwendung:
Sättigungs-Index (nach Langelier): pHMessung – pHSättigung
Stabilitäts-Index (nach Ryznar): 2 x pHSättigung – pHMessung
Die Wasserinhaltsstoffe werden mittels Methoden der analytischen Chemie bestimmt. Die Wasseranalyse sollte unbedingt folgende Komponenten enthalten:
Kationen: Calcium (Ca2+) Anionen: Chlor (Cl-)
Kalium (K+) Hydrogenkarbonat (HCO3-)
Magnesium (Mg2+) Nitrat (NO3-)
Natrium (Na+) Sulfat (SO42-)
Phosphat (PO42-)
Zu beachten ist weiterhin die Wasserverschmutzung in Form von Sand, Schlamm oder Schleim. Deshalb sind mechanische Vorreinigungen, z. B. Absetzbecken, Siebrechen usw., empfehlenswert.
Wasseraufbereitungsverfahren
Unter Wasseraufbereitung versteht man die Behandlung des Wassers, um seine Beschaffenheit dem jeweiligen Verwendungszweck und gewünschten Anforderungen anzupassen (DIN 4046).
Die moderne Wassertechnologie verfügt über Aufbereitungsverfahren für jeden möglichen Wasserzustand und viele Nutzungsformen des Wassers.
Filtration
Die Filtration führt zu einer Konzentrationsänderung des Wassers, d.h. zur Verminderung suspendierter Feststoffe auf < 1 mg/l H2O. Allgemein bestehen Filter aus einem Behälter, gefüllt mit dem Filtermedium, z. B. Quarzsand bzw. -kies, Hydroanthrazit, Blähton, Bimsstein, Kunststoffgranulat usw., das die Schwebstoffe bei der Durchströmung zurückhält. Aufgrund der Ablagerungen im Filterbett entsteht ein Druckabfall in der Strömung, so dass Verstopfungen auftreten und die Betriebsdauer der Filter begrenzen. Durch eine Rückspülung des Filters wird die Funktionstüchtigkeit wieder hergestellt.
Die vielen Einsatzgebiete der Filter führten zu folgenden Unterscheidungsmerkmalen:
Nach der Bauart, z. B. offene Filter (Schwerkraftfilter), geschlossene Filter (Druckfilter);
Nach der Strömungsgeschwindigkeit, z. B. Schnellfilter (w = 3…50 m/h), Langsamfilter (w < 10 m/d);
Nach der Strömungsrichtung, z. B. Abstromfilter und Aufstromfilter;
Nach der Rückspülung, z. B. rückspülbare und nicht rückspülbare Ausführungen;
Nach der Betriebsweise und dem Aufbau des Filtermediums, z. B. Ein- und Mehrstufenfilter, Ein- und Mehrschichtfilter.
Als Filtermedien werden engklassierte, chemisch inerte Körnungen gewählt, deren Wirkung durch das Porensystem oder sich bildende aktive Kornbeläge entsteht. In Sonderfällen wird Aktivkohle eingesetzt. Sie beseitigt Geschmacks- und Geruchseinflüsse und absorbiert Spuren von Chlor und Oxidationsmitteln.
Bei der Rohwasseraufbereitung wird meist der Gesamtwasserstrom filtriert, während für die Reinwasserbehandlung oft eine Teilstromfiltration (< 20 %) ausreicht.
Flockung
Bestimmte Wasserinhaltsstoffe, z. B.
Kolloide organischer und anorganischer Verbindungen,
grobdisperse Stoffe,
Substanzen mit kleinen, langsam sedimentierenden Teilchen,
evtl. auch echt gelöste Stoffe,
werden durch Flockung reduziert.
Stoffe, die im Wasser kolloidial verteilt sind, verhalten sich in der Lösung stabil und sedimentieren nicht, da eine elektrische Doppelschicht sie umgibt. An der Oberfläche befinden sich negative elektrische Ladungen, die adsorbiert wurden oder anionischen Gruppen des Kolloids angehören, z. B. Huminsäuren. Der Ladungsausgleich erfolgt in einer bestimmten Entfernung zur Oberfläche. Innerhalb dieser Schicht stoßen sich Kolloidteilchen ab, ein Nachweis der Stabilität von Kolloiden. Bei der Wanderung der Kolloide im elektrischen Feld entsteht eine Scherfläche, die die elektrische Ladung der Elektrophorese, genannt Zetapotenzial, bestimmt.
Die technische Flockung umfasst die
Koagulation (perikinetische Phase)
(Primärvorgang der Flockenbildung; Mikroflocken)
Durch den Einbau großer Polykationen wird die negative Ladung kompensiert und es kommt zur Zusammenballung. Bereits geringe Flockungsmittelmengen entstabilisieren die Kolloide. Der Kontakt der kolloiden Teilchen erfolgt durch die Brown’sche Bewegung. Die Überdimensionierung der Flockungsmittel führt zur Bildung eigener Kolloide und Reststabilisierung.
Flockulation (orthokinetische Phase)
(Bildung sichtbarer Flocken; Mikroflocken)
Die Flockungsmittel bilden langgestreckte Moleküle infolge der Vernetzung von Kolloiden. Dieser Prozess ist nicht mehr umkehrbar.
Das Henry’sche Gesetz beschreibt die Wanderungsgeschwindigkeit der Kolloidteilchen:
WF = f · [m/s]
mit:
f = 0,15…0,25 = Faktor der Doppelschichtdicke und geometrischen Teilchenform (Kugel, Zylinder),
ZP = Zeta-Potential,
e = Elektrizitätskonstante
E = elektrische Feldstärke
h = dynamische Viskosität
Für die elektrische Feldstärke E = 1 V/cm sind die Stoffeigenschaften des Wassers bekannt. Die Wanderungsgeschwindigkeit wF und das Zeta-Potential ZP sind proportional.
Als Flockungsmittel werden verwendet:
Metallsalze,
organische Polymere.
a) Metallsalze
Eisen(III)-chlorid hat einen optimalen Einsatzbereich bei pH = 5,5…7,5. Dafür gilt:
FeCl3 + 3 H2O ➝ Fe(OH)3 + 3 H+
Anstelle von Eisen(III)-chlorid wird auch chloriertes Eisen(II) verwendet. Der Dosierlösung wird Chlor im stöchiometrischen Verhältnis zugegeben und vollständig umgesetzt, so dass das Flockungsmittel kein freies Chlor enthält.
Aluminiumsulfat hat einen ähnlichen optimalen pH-Bereich: pH = 5,5…7,2. Die Reaktionsgleichung lautet:
0,5 Al2(SO4)3 + 3 H2O ➝ Al(OH)3 + 3 H+
Aluminium und Eisen bilden bei der Hydrolyse Polykationen, die Kolloide entstabilisieren. Aluminium ist im alkalischen Zustand als Aluminat wieder löslich. Bei den Metallsalzen ist die pH-Wert - Absenkung zu berücksichtigen.
Im alkalischen Bereich (pH > 7) ist eine Kalkdosierung möglich:
CaO + CO2 ➝ CaCO3
Im Kalküberschussverfahren dient es auch der Wasserenthärtung. Magnesium wird als Hydroxid gefällt. Jede Kalkflockung erfordert eine pH-Wert-Korrektur.
b) Organische Polymere
Verschiedene polymere organische Verbindungen eignen sich ebenfalls als Flockungsmittel. Ihre Wirkung beruht auf Entstabilisierung und/oder Vernetzung der Kolloide. Im Vergleich mit den Metallsalzen sind sie relativ kostenaufwendig. Deshalb werden sie häufig als Flockungshilfsmittel der Metallsalze verwendet.
c) Flockungsverfahren
Verfahrenstechnisch sind zu unterscheiden:
Flockungsfiltration,
d.h. Abtrennung der Flocken durch Filtration des Wassers über gekörnte Filtermedien. Die Bildung gut absetzbarer Flocken ist dabei nicht notwendig.
Sedimentationsflockung,
d.h. Absetzung der Flocken mittels Sedimentation in Absetzbecken, Schwebfiltern usw. Dieser Flockungsprozess erfordert große, kompakte und gut absetzbare Flocken.
Zur Auswahl des optimalen Flockungsverfahrens sind Vorversuche empfehlenswert.
Enthärtung
Die technische Wassernutzung wird häufig durch die Wasserhärte behindert. Spezielle Enthärtungsverfahren sollen den Gehalt an Hydrogenkarbonationen reduzieren (Teilenthärtung) oder völlig beseitigen (Vollenthärtung).
Die klassischen Enthärtungsverfahren führen zu einer Teilenthärtung.
Kalkmilch- bzw. Kalkwasserzugabe zur Fällung von Calciumkarbonat, Magnesiumkarbonat und -hydroxid als Härtebildner.
Ca2+ + CO2 + 2 (OH)- ➝ CaCO3 + H2O
Mg2+ + CO2 + 2 (OH) ➝ MgCO3 + H2O
Mg2+ + 2 (OH)- ➝ Mg(OH)2
Säureimpfung durch Zugabe von Mineralsäure zur Umsetzung von Hydrogenkarbonat in Kohlenstoffdioxid, der anschließend mittels Gasaustausch ausgetrieben wird.
cH = cHCO3
Die Anionenkonzentration erhöht sich um den gleichen Betrag.
Soda-Verfahren sind teilweise veraltet und werden durch moderne Ionenaustausch-Verfahren ersetzt.
Phosphat-Verfahren ermöglichen eine Nachenthärtung bereits aufbereitetem Wassers, beispielsweise:
3 Ca(HCO3)2 + 2 Na3PO4 ➝ Ca3(PO4)2 + 6 NaHCO3
3 CaSO4 + 2 Na3PO4 ➝ Ca3(PO4)2 + 3 Na2SO4
3 CaCl2 + 2 Na3PO4 ➝ Ca3(PO4)2 + 6 NaCl
(anstelle Ca kann auch Mg gewählt werden)
Die Restkarbonathärte beträgt DKH = 1…2 °dH, die Restgesamthärte DGH ist um den Mg-Anteil höher.
Verfahrenstechnisch kommen zur Anwendung:
die Langsamentkarbonisierung,
durchgeführt in Flockungs- oder Sedimentationsanlagen, wobei meist Trübstoffe, Eisen und Mangan und organische Stoffe zu entfernen sind. Die Verweildauer beträgt 1 bis 3 h; als Abfall fällt Schlamm an;
die Schnellentkarbonisierung,
in speziellen Schwebefiltern. Die Reaktion wird durch Erwärmung beschleunigt. Die auskristallisierten Reaktionsprodukte werden in Quarzsand (ø 0,3…0,5 mm) eingebettet und abgeführt. Die Verweildauer beträgt nur 5 bis 10 min.
Die Vollenthärtung des Wassers (DGH < 0,1 °dH) erfolgt durch Ionenaustauschverfahren. Dabei werden Ionen der Austauschermasse gegen Ionen des Wassers ausgetauscht.
Entsalzung
Das Wasser wird durch einen stark sauren Ionenaustauscher (H-Form) und einem nachgeschalteten schwach basischen Ionenaustauscher (OH-Form) praktisch entsalzt, es enthält nur Kohlensäure und Kieselsäure. Neutrales Wasser erfordert zusätzlich ein Pufferfilter mit einem schwach sauren Kationenaustauscher.
Zur Vollentsalzung wird ein stark basischer Ionenaustauscher eingesetzt, um auch die Kohlensäure und Kieselsäure auszutreiben. Sie ist aber auch mittels Mischbettfilter möglich, wenn diese stark saure Kationenaustauscher und stark basische Anionenaustauscher enthalten. Kondensatentsalzungssysteme werden vorwiegend mit Mischfiltern als Endstufe ausgerüstet.
Entgasung
Im Wasser gelöste Gase (O2, CO2) werden durch ein Zwei-Stufen-Verfahren ausgetrieben. Kleinanlagen werden häufig nur mit der 2. Stufe ausgerüstet.
1. Stufe: Thermische Entgasung
Die Löslichkeit der Gase ist vom Partialdruck abhängig. Das Wasser wird mit Heizdampf zum Sieden gebracht um den Partialdruck abzusenken. Frei werdende Gase werden in die Atmosphäre abgeführt. Die thermische Entgasung erfolgt bei Unterdruck bzw. Vakuum. Der Restsauerstoff beträgt dann DO2 = 0,007…0,012 mg/kg H2O. Trotz der Wärmeverluste ist eine Absaugung der Gase mittels Vakuumpumpen empfehlenswert.
2. Stufe: Chemische Entgasung
Das gebräuchliste Entgasungsmittel für Sauerstoff ist Hydrazin (N2H4). Die Umsetzungsgeschwindigkeit ist sehr hoch, ohne den Salzgehalt des Wassers zu erhöhen.
N2H4 + O2 ➝ 4 NH3 + N2
Überschüssiges Hydrazin wird in einem Kessel in Ammoniak und Stickstoff aufgespalten:
3 N2H4 ➝ 4 NH3 + N2
Ammoniak gelangt mit dem Dampf in das Kondensat und erhöht den pH-Wert. Im Kesselwasser enthaltene freie Kohlensäure strömt mit dem Dampf in das Kondensat und bildet mit dem Ammoniak Ammoniakbikarbonat. Eine Dosierung von Ammoniak bindet die Kohlensäure im Kondensat.
Bei diesem Verfahren darf der Kondensatbereich nicht aus Kupfer oder Kupferlegierungen bestehen, denn bei Anwesenheit von Sauerstoff werden diese Werkstoffe von Ammoniak angegriffen und korrodieren.
Ionenaustausch
Der Ionenaustausch ist ein Sorptionsprozess, ursprünglich mittels Verwendung natürlicher Stoffe, z.B. Tonminerale, Huminstoffe, Zeolithe. Heute kommen Kunstharzionenaustauscher zur Anwendung, die aus Gerüstbildnern, Vernetzer und Ankergruppen bestehen. Polykondensation bzw. Polymerisation sind die Grundlagen des Gerüstaufbaus und der Vernetzung. Die Ankergruppen machen das Kunstharz hydrophil und somit fähig für den Ionenaustausch.
Entsprechend der jeweiligen Aufgabenstellung werden Ionenaustauscher unterteilt in:
stark saure Kationenaustauscher (R – SO3 – H+)
für die Vollentsalzung;
schwach saure Kationenaustauscher (R – COO- - H+)
für die Hydrogenkarbonatspaltung
Ca(HCO3)2 + 2 XH CaX2 + 2 H2O + 2 CO2;
schwach basische Anionenaustauscher (R – NH3+(OH)-)
für die Entfernung der Kieselsäure;
stark basische Anionenaustauscher (R – N+(OH)-)
zum Kohlensäureaustrieb.
Diese Aufgaben erfolgen in zwei Phasen:
Arbeitsablauf,
Regenerierung.
[1] Wissen im Überblick – Die Natur“, Vrlag Herder Freiburg / Brsg., 1970
[2] H.-D. Held / H. Schnell: „Kühlwasser“ , lkan Verlag Essen, 2000
[3] „Grundlagen der industriellen Wasserbehandlung“,
Drew Chemical Corporation, Boonton / New Jersey / USA, 1980
[4] H. Schnell / B. Slipcevic: „Ursachen und Auswirkungen der Ver- schmutzung und Verkrustung von Wärmeübertragungs-
flächen“, Z. Chemie-Ingenieur-Technik, 1984
[5] H. Schnell: „Technische Rückkühlung“, in: „Handbuch Wärme-
austauscher“, Vulkan Verlag Essen, 1988
Jetzt Artikel freischalten:
tab DIGITAL
14 Tage kostenlos testen
2,49 € / Woche*
Fachwissen jederzeit und überall.
Greifen Sie auf exklusive PLUS-Artikel und das komplette Online-Archiv zu und lesen Sie tab bequem im E-Paper-Format. Das digitale Abo für alle, die flexibel bleiben möchten.
Ihre Vorteile:
- Exklusive tab-PLUS-Artikel
- 6 E-Paper für mobiles Lesen
- Online-Archivzugang
*129,48 € bei jährlicher Abrechnung inkl. MwSt.
tab KOMBI
4,99 € / Woche*
Das komplette tab-Erlebnis – digital & gedruckt.
Für alle, die Fachinformationen auf allen Kanälen nutzen möchten: Kombinieren Sie Print und Digital, profitieren Sie von unseren Fachforen und präsentieren Sie Ihr eigenes Projekt.
Ihre Vorteile:
- Exklusive tab-PLUS-Artikel
- 6 Print-Ausgaben pro Jahr
- E-Paper für mobiles lesen
- Teilnahme an einem Fachforum
- Online-Archivzugang
- Veröffentlichen eines Projekts
*259,48 € bei jährlicher Zahlung inkl. MwSt. & Versand